 TP : L'ÉLECTROPHORÈSE D'ADN :
TP : L'ÉLECTROPHORÈSE D'ADN :
(photos et schémas en bas de page)
1.
Preparation du TP :
Préparation
du tampon TBE :
Diluer
10x les 100 mL de tampon dans un flacon d'1 L en rajoutant 900 mL d'eau distillé.
Préparation
du gel d'agarose :
Transvaser
les 1,6 g d'agarose dans un flacon passant au micro-onde et y rajouter 120
mL de tampon TBE. Placer le tout au micro-onde à 1000W pendant 2 à 3 minutes.
Surveiller toutes les 30 secondes l'état de la solution jusqu'à qu'elle soit
transparente et sans grumeaux. Faire refroidir le tout.
Coulage
des gels :
Couler
le liquide dans les moules à électrophorèse puis y placer le peigne afin d'y
avoir des puits. Laisser refroidir jusqu'à solidification. Puis démouler les
puits et placer le moule dans la cuve à électrophorèse.
Préparation
de l'azur A (le colorant) :
Préparer
une solution d'ethanol à 20% en diluant 80 mL d'ethanol pur dans 320 mL d'eau
distillée dans une éprouvette graduée.
Verser
le sachet d'Azur A dans un flacon et y ajouter les 400 mL d'ethanol à 20%.
2.
Manipulation :
Prélever
à la micro-pipette 10 µL de bleu de dépôt et le placer dans un micro-tube
contenant l'ADN du phage λ (individu 1). Recommencer l'opération avec le
tube contenant l'ADN de phage λ muté (individu2), celui de phage λ
digéré par HindIII et celui de phage λ muté digéré par HindIII .
Pour
remplir les puits, prelever 12 µL de chaque solution pour les placer dans les
puits en notant bien leur emplacement. Remplir un cinquième puit avec une des
solutions utilisées précédemment. Dans le cadre de notre TPE, l'ADN placé
deux fois serait celui du suspect ainsi que celui de l'individu coupable (évidemment
ils seront identiques). Utiliser l'ADN de phage λ non muté digéré par
l'enzyme HindIII considéré comme l'ADN x (inconnu).
Lancer
immédiatement l'électrophorèse pour éviter que les dépôts diffusent
dans le gel.
Pour
cela, fermer le couvercle et brancher la cuve. Régler la tension a 70 V.
Laisser
migrer ¾ d'heure à 1h30.
Une
fois la migration terminée, retirer le gel de la cuve en faisant attention à ne
pas le casser car le gel est fragile. Rincer le gel à l'eau distillée puis le
placer dans un récipient et le recouvrir du colorant préparé précédemment.
Laisser le gel dans ce bain pendant 5 minutes environ puis le rincer dans un
bain d'eau ou sous l'eau courante (si le gel est très coloré, éliminer
l'excès de colorant avec quelques mL d'alcool à 70% puis éliminer cet alcool
à l'eau du robinet jusqu'à ce que l'eau soit translucide)
On
devrait voir apparaître des bandes sur le gel au bout de quelques minutes mais
l'intensité maximale de la coloration s'observera au bout de quelques heures,
voire quelques jours.
3.
Interprétation de nos résultats (modélisation simplifiée de
l'identification génétique):
L'électrophorèse
de l'ADN des phages λ mutés et non mutés non digérés a donné pour chacun
une bande à une distance identique, car la longueur de l'ADN de chaque phage
est identique (48 502 paire de bases). On en déduit la nécessité de les faire
digérer par une enzyme pour les distinguer l'un de l'autre.
Donc
on fait digérer l'ADN des phages λ mutés et non mutés par l'enzyme HindIII
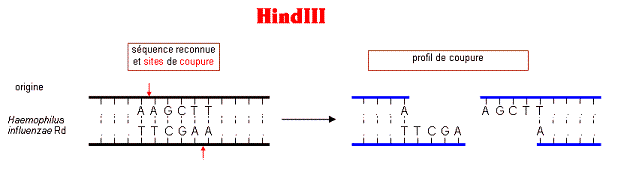
qui découpe l'ADN (voir site de restriction).
Pour
le phage λ non muté, on obtient sept fragments de longueurs différentes
(voir électrophorèse), donc il y a eu six sites de restriction (schéma carte
de restriction).
Pour
le phage λ muté, on obtient huit fragments de longueurs différentes (voir
électrophorèse), donc il y a eu sept sites de restriction (schéma carte de
restriction), un de plus que pour l'ADN de phage λ non muté, un
fragment de 9416 paires de nucléotides a été découpé en deux fragments de
respectivement 6019 et 3397 paires de nucléotides. Ainsi il est donc possible de distinguer
les deux ADN à l'aide du nombre de fragments obtenus.
Pour
l'individu x, on constate que l'on obtient sept fragments, donc sept sites de
restriction pour l'enzyme HindIII, comme pour l'ADN de phage λ non muté.
Ces fragment ont migré de la même façon que les fragments d'ADN de l'ADN de
phage λ non muté (individu 1), donc l'individu x correspond à l'ADN
de l'individu 1.
Cartes de restriction de l'enzyme HindIII sur les phages λ non mutés et mutés.

On s'aperçoit que le phage λ muté possède une zone de restriction supplémentaire par rapport au phage λ non muté, ce qui explique la bande noire supplémentaire sur l'électrophorèse.
Site de restriction de l'enzyme HindIII et le profil de coupure
Résultats obtenus lors de l'électrophorèse des individus 1 (phage λ non muté) et 2 (phage λ muté)
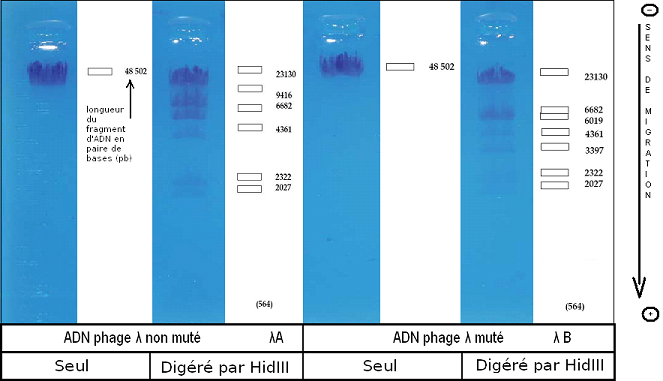
Si l'on observe les électrophorèses des phages λ non muté et muté digérés par l'enzyme, on s'aperçoit bien d'une bande supplémentaire sur celle du phage λ muté. Et si on observe la longueur des fragments, on voit nettement que le deuxième de l'ADN du phage λ non muté a un nombre de paires de bases égal à l'addition des 3ème et 5ème fragments de l'électrophorèse de l'ADN du phage λ muté. Tous les autres fragments ont des tailles identiques sur les deux électrophorèses.
Résultats obtenus lors de l'électrophorèse de l'individu x (modélisé donc par le phage λ non muté)
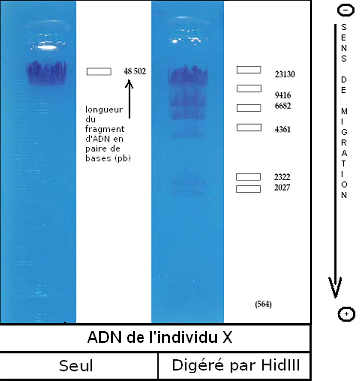
Si on regarde l'électrophorèse de l'ADN de cet individu digéré par l'enzyme HindIII, on remarque que les tailles des différents fragments et leurs distances de migration sont identiques à celle du phage λ non muté. Nous pourrons donc en conclure que c'est le même ADN qui a été utilisé pour la migration (ce qui est effectivement le cas)
© http://tpe-2010-lycee-galilee.max.st/ 2010 | Design by Kitgraphiquegratuit.org